| ||||||||
|
САНКТ-ПЕТЕРБУРГ | ||||||||
Мы приглашаем вас насладиться красками природы, посетив галерею фотографий.
Реклама |
комплексные поставки лакокрасочных материаловлаки, краски, эмали, грунтовки, шпатлевки |
|
Поскольку практически невозможно найти растворители, отличающиеся друг от друга только диэлектрической проницаемостью при равных кислотности и основности, расчеты по уравнению (4.10) обычно плохо согласуются с экспериментальными данными. Кроме того, сольватирующая способность и полярность растворителя определяются не только его диэлектрической проницаемостью. Помимо чисто электростатического куло новского взаимодействия существуют другие типы специфического и неспецифического взаимодействия, в том числе ион-ди польное, диполь-дипольное, образование водородных связей и ионных пар и т. д. К тому же модель, используемая для описания электростатического взаимодействия, не учитывает реальные форму и размеры конкретных ионов. Например, в отличие от карбоновых кислот константа кислотности пикриновой кислоты при переходе от этанола к воде возрастает только в 1500 раз (см. табл. 4.1). Это объясняется делокализацией отрицательного заряда аниона пикриновой кислоты по всей довольно большой молекуле, в результате чего энтальпия сольватации этого аниона значительно уступает энтальпии сольватации анионов карбоновых кислот. Это означает, что при повышении сольватирующей способности растворителя стабильность пик рата меняется в иной степени, чем у анионов карбоновых кислот, в которых отрицательный заряд в большей или меньшей степени локализован только на двух атомах кислорода. Влияние растворителей на силу кислот и оснований можно изучить детальнее с помощью коэффициентов активности. Выраженные в единицах концентрации константы равновесия зависят от природы растворителя. Так называемые термодинамические константы равновесия, не зависимые от растворителя, можно получить, подставив в соответствующих выражениях вместо концентраций активности участвующих в равновесии частиц. Термодинамическая константа равновесия К реакции ΗΑ =Η®-|-ΑΘ определяется следующим уравнением:
В сильно разбавленных водных растворах коэффициенты активности приближаются к единице. Следовательно, в водных растворах при бесконечном разбавлении К и К* становятся практически равными. Если для растворителя SH константу равновесия, выраженную в единицах концентрации, обозначить Ksh, а величину /Са в воде при бесконечном разбавлении /Сн2о, то тогда
Здесь символами γ обозначены соответствующие коэффициенты активности в растворителе SH. Аналогично для другой кислоты, которая ионизируется в соответствии с уравнением НВ= Η®+Βθ, можно записать такое уравнение: |
| ||||||||||||||||||||||||

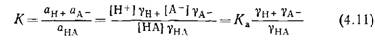
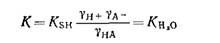 (4.12)
(4.12)