| ||||||||
|
САНКТ-ПЕТЕРБУРГ | ||||||||
Мы приглашаем вас насладиться красками природы, посетив галерею фотографий.
Реклама |
комплексные поставки лакокрасочных материаловлаки, краски, эмали, грунтовки, шпатлевки |
|
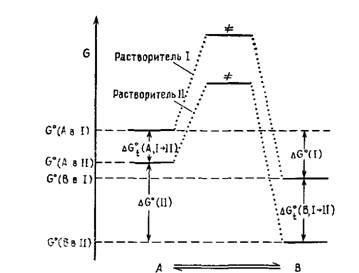
4 Влияние растворителей на положение гомогенного химического равновесия 4.1. Введение Равновесие называют гомогенным, если все компоненты системы находятся или только в газовой фазе, или только в растворе. При равновесии в газовой фазе отношение концентраций продуктов реакции к концентрациям исходных соединений при данной температуре постоянно (закон действующих массГульд берга и Вааге, 1867 г.). Если все компоненты реакционной массы находятся в растворе, то в результате межмолекулярных взаимодействий растворителя с растворенным веществом высвобождается энергия Гиббса сольватации; в общем случае для исходных веществ и продуктов реакции стандартная молярная энергия Гиббса сольватации AG0 солъв различна, поэтому при переходе от тазовой фазы к раствору равновесие смещается [1— 4J. Константа равновесия может остаться постоянной только в том случае, когда А0°СоЛьз исходных веществ и продуктов реакции совпадают. Влияние среды на положение химического равновесия можно оценивать двумя путями: во-первых, сравнивая константы равновесия в газовой фазе и в растворе и, во-вторых, сравнивая константы равновесия в различных растворителях. К сожалению, и в газовой, и в жидкой фазах изучалось крайне ограниченное число равновесных реакций [5, 6], к числу которых относятся главным образом неионные процессы, где взаимодействие между реагентами и растворителем незначительно (например, реакция димеризации циклопентадиена по Дильсу — Альдеру). Поэтому в настоящей главе будут рассматриваться в основном результаты изучения равновесных реакций в растворителях различной полярности (за исключением кислотно-основного равновесия, разд. 4.2.2). Рассмотрим простую реакцию изомеризации А= В в растворителях I и II, обладающих различной сольватирующей способностью по отношению к А и В. Изменение энергии Гиббса в этих системах можно изобразить графически, например так, как на рис. 4.1. Из приведенных на рис. 4.1 данных непосредственно вытекает следующее уравнение:
После преобразований получим уравнение [102] |
| |||||||||||||||||||||||||