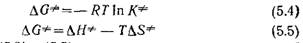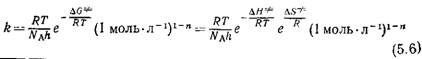| ||||||||
|
САНКТ-ПЕТЕРБУРГ | ||||||||
Мы приглашаем вас насладиться красками природы, посетив галерею фотографий.
Реклама |
комплексные поставки лакокрасочных материаловлаки, краски, эмали, грунтовки, шпатлевки |
|
е. Считается, что изменение энергии Гиббса активации при переходе от газовой фазы к раствору или от одного растворителя к другому обусловлено1, различной степенью сольватации реагентов и активированного комплекса; при этом подразумевается, что в растворе исходные вещества и активированный комплекс находятся в тепловом равновесии с растворителем. Это предположение не оправдывается в случае быстрых хими-
ческих реакций с медленной переориентационной релаксацией молекул растворителя. Если энергетический барьер реакции достаточно широк, а релаксация молекул растворителя замедленна, то скорость реакции будет определяться переориентацией молекул растворителя и теория переходного состояния может оказаться несостоятельной [463, 465, 466]. Поскольку считается, что скорость реакции пропорциональна концентрации активированного комплекса, то константа удельной скорости реакции k должна быть пропорциональна Кф. С помощью статистических расчетов можно показать, что коэффициент пропорциональности в этом случае равен k%Tjh. Если каждый активированный комплекс, пройдя через переходное состояние, превращается в продукты реакции (т. е. если коэффициент прохождения близок к единице) и коэффициенты активности также близки к единице, то константу удельной скорости элементарной реакции можно выразить уравнением Здесь k — константа скорости с Согласно этому простому уравнению, константа скорости любой химической реакции равна произведению константы равновесия на универсальный коэффициент частоты kBT/h, зависящий только от температуры*. Поскольку Кф — константа равновесия, то с помощью уравнений (5.4) и (5.5) можно определить параметры &.G*, АНФ и называемые энергией Гиббса, энтальпией и энтропией активации соответственно:
Из уравнений (5.3) — (5.5) следует, что константу удельной скорости реакции для стандартного состояния (1=1) можно также выразить уравнением Принято считать, что с помощью уравнения (5.6) можно описывать реакции в растворах, хотя, по-видимому, оно справедливо только для систем идеальных газов. Согласно этому уравнению, чем меньше Αΰφ, т. е. разность между энергиями Гиббса реагентов и активированного комплекса, тем больше скорость химической реакции. |
| |||||||||||||||||||||||||

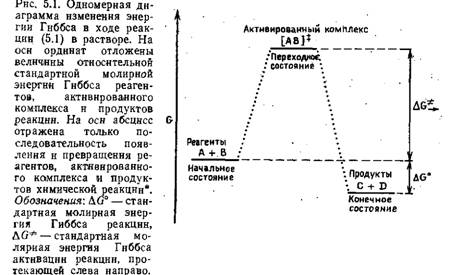
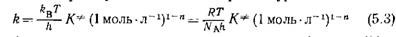 размерностью (моль-л-1)1-™ (время)-1, kB — постоянная Больцмана, h — постоянная Планка, Τ — абсолютная температура, R — газовая постоянная, Кф — термодинамическая константа квазиравновесия (отнесенная к гипотетическому стандартному состоянию равновесия между исходными реагентами и активированным комплексом при молярной концентрации, равной единице), η—молекулярный « кинетический порядок элементарной реакции (обычно п= 1 или 2).
размерностью (моль-л-1)1-™ (время)-1, kB — постоянная Больцмана, h — постоянная Планка, Τ — абсолютная температура, R — газовая постоянная, Кф — термодинамическая константа квазиравновесия (отнесенная к гипотетическому стандартному состоянию равновесия между исходными реагентами и активированным комплексом при молярной концентрации, равной единице), η—молекулярный « кинетический порядок элементарной реакции (обычно п= 1 или 2).